1 實驗原理
抗壞血酸是一種弱酸,也是一種較強的還原劑,可與一系列中等強度的氧化劑反應生成去氫抗壞血酸,可以用于和Fe(Ⅲ)反應:
C6H6O4+2Fe3+= C6H4O4+ 2H++2Fe2+
在上述反應中有H+生成,溶液中的pH值要發生變化。
隨著反應發生生成H+逐漸增加,溶液的pH值呈減小趨勢,當達到滴定終點時,Fe3+全部轉化為Fe2+,C6H6O4進入溶液后不再生成H+,靠C6H6O4做為弱酸電離產生的H+極少而溶液的體積不斷變大,pH值將緩慢升高,pH最小的時候就是滴定的終點。所以我們可以用pH監測終點,達到測定的目的。
2 實驗過程
2.1 實驗儀器與藥品
PHBJ-260型便攜式pH計;電子天平;干燥箱;磁力恒溫攪拌器;
赤鐵礦粉(用于煉鐵的原料);秒表;抗壞血酸;濃鹽酸等。
2.2 樣品處理
將鐵礦粉在干燥箱內100℃條件下干燥2h,冷卻后準確稱量1.000g礦粉于500mL燒杯中,先用少量水進行潤濕,再加入40mL濃鹽酸,并蓋上表面皿置于近沸水浴中進行加熱,直至紅褐色顆粒完全消失(剩有近白色固體SiO2),然后加入少量H2O2,微沸幾分鐘,待稍微冷卻以后轉移到100mL容量瓶中用蒸餾水進行定容備用。
2.3 抗壞血酸溶液的配制
稱量2.225g抗壞血酸溶解并定容至250mL搖勻,裝入沖洗干凈的醫用注射瓶內,隨用隨配。
2.4 測定
準確移取待測液10mL置于50mL小燒杯內將其放在磁力恒溫攪拌器上進行攪拌,固定PHBJ260-S型便攜式pH計,使電極底端的玻璃球浸沒在待測液內,開啟攪拌器。并用濃氨水和3mol/L的鹽酸進行調節pH值為2左右,將便攜式pH計與電腦聯機(將便攜式pH計的接線柱與電腦相連即可),選擇PH測定界面。調整滴定流速為1滴/秒進行測定,電腦開始采集并記錄數據,當溶液顏色由棕褐色變為無色再滴定一段時間之后停止測定。進行平行測定3次,將測量結果在計算機上保存以便使用。
2.5 液滴體積矯正
對標準抗壞血酸流速為1滴/s時進行體積矯正。經多次滴定得出一滴抗壞血酸體積為0.015mL。
3 測定結果分析
選擇第一次的測定結果為例,將pH曲線轉化到word文檔,便于直觀分析,結果如圖1。從圖上,我們可以看出隨著反應發生生成H+逐漸增加,溶液的pH值呈減小趨勢,當達到滴定終點時,Fe3+全部轉化為Fe2+,C6H6O4進入溶液后不再生成H+,靠C6H6O4做為弱酸電離產生的H+極少而溶液的體積不斷變大,pH值將緩慢升高,pH最小的時候就是滴定的終點。
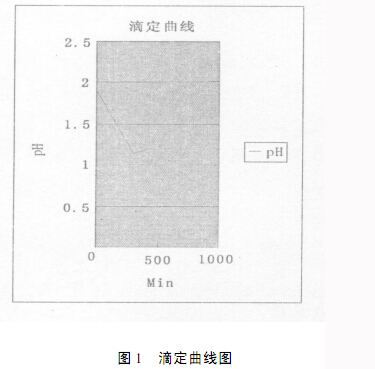
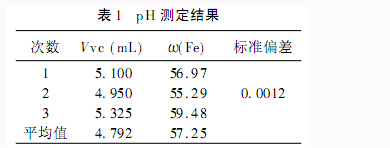
計算批pH最小時Vc的體積,Vc的數值可在電腦存儲的數據中直接讀出,然后按照ω(Fe)=2Vvc-Cvc×10-3×MFe/m樣×100計算鐵含量。按此法計算其他兩次的數值。將結果填入表一中,計算標準偏差和平均值。
4 注意事項
4.1 本法測赤鐵礦中的總鐵含量,關鍵在于溶液pH值的調節,調節時不易出現沉淀,調到pH為2左右。
4.2 由于抗壞血酸易被空氣氧化,需要現用現配。











